Увы, но сталкиваться с коррозией нам приходится практически во всех областях нашей жизни. И ничего загадочного в ней нет — это вполне естественное изменение любого металла. Протекающие при этом процессы примитивными не назовешь, но и особо сложного тут тоже ничего нет.
Поскольку коррозия значительно ускоряется при наличии воды или влаги, флот, в том числе и маломерный, попадает в особую «группу риска». Бороться с коррозией не только нужно, но и можно. Причем для борьбы с ней можно задействовать те же самые процессы, которые ее вызывают, предложив этому неуловимому всепожирающему чудищу альтернативную «пищу».
Чтобы лучше понять, что такое коррозия, начнем с наиболее распространенной ее разновидности — ржавчины. Все мы имели с ней дело, но чтобы понять, как она возникает, придется освежить в памяти школьные уроки химии.
С точки зрения химика железная руда представляет собой два атома железа, связанных тремя атомами кислорода (Fe2O3 ). Добытый из земли коричневато-красный порошок сам по себе ни на что не годен. Но после процессов его очистки и выплавки мы получаем железо или чугун — материал куда более полезный.
Использовать его можно как в чистом виде, так и в улучшенном, получая при добавлении иных химических элементов различные сорта стали.
Всем известно, что происходит с железными изделиями под воздействием воды — они ржавеют.
Если процесс идет достаточно долго, то, скажем, от железного гвоздя в итоге останется лишь кучка коричневато - красного порошка — ржавчины, или оксида железа, имеющего уже знакомую нам химическую формулу Fe2O3 .
Да - да, ржавчина — оксид железа — имеет абсолютно тот же состав, что и железная руда. И вот почему. Атомы железа стремятся вернуться в свое естественное состояние, в котором они находятся состояние, в котором они находятся в составе руды, ржавчины или оксида железа. В нем они наиболее стабильны.
Стремление к подобному состоянию присуще не только железу, но и практически всем прочим металлам, используемым в промышленности.
Тот вид коррозии, которому подвергается оставленное под дождем железное изделие, включает в себя не только химические, но и физические процессы. Происходящую реакцию принято именовать электрохимической.
Для того, чтобы два атома железа смогли соединиться с тремя атомами кислорода (и образовать Fe2O3 ), они должны объединиться электронами (крошечными частицами, вращающимися вокруг атомов). При этом несколько электронов освобождается.
И сколько электронов освобождается. И поскольку электричество — это попросту движение свободных электронов, то при химической реакции вырабатывается и электрический ток.
Не забывайте, что железо стремится к превращению в оксид железа, потому что это его естественное, наиболее стабильное состояние. Необходим для этого только кислород. «Поставщиком» кислорода является вода, так что при наличии влаги железо ржавеет гораздо быстрее.
Все это в полной мере применимо к оксиду алюминия и собственно алюминию, из которого делают подводные части подвесников и угловых колонок. Вот, в общем, и все секреты коррозии металла, в основе которой лежит электрохимическая реакция.
Такой тип коррозии принято еще называть гальванической (хотя далеко не всякая электрохимическая реакция — гальваническая коррозия).
Расположенные под водой металлические детали обычно подвергаются двум типам коррозии: гальванической и так называемой «коррозии от блуждающих токов».
Гальваническая коррозия представляет собой электрохимическую реакцию между двумя или несколькими различными (или разнородными) металлами. Различными, поскольку, для того чтобы началась реакция, один должен быть химически более активным (или менее стабильным), чем другой или другие.
Когда мы говорим про гальваническую коррозию, то имеем в виду электрообмен. Все металлы обладают электрическим потенциалом, поскольку у всех атомов есть электроны, движение которых и есть электричество.
Гальваническая коррозия более активного металла начинается в тот момент, когда две или более детали из разнородных металлов, имеющие взаимный контакт (при обычном соприкосновении, или же посредством проводника) помещаются в электролит (любую жидкость, проводящую электричество, за исключением дистиллированной воды).
Не только соленая морская, но и обычная вода из-под крана благодаря наличию минеральных веществ является превосходным электролитом, причем с ростом температуры электропроводность ее только растет (по этой причине корпуса судов, эксплуатирующихся в жарком климате, заметно больше подвержены коррозии).
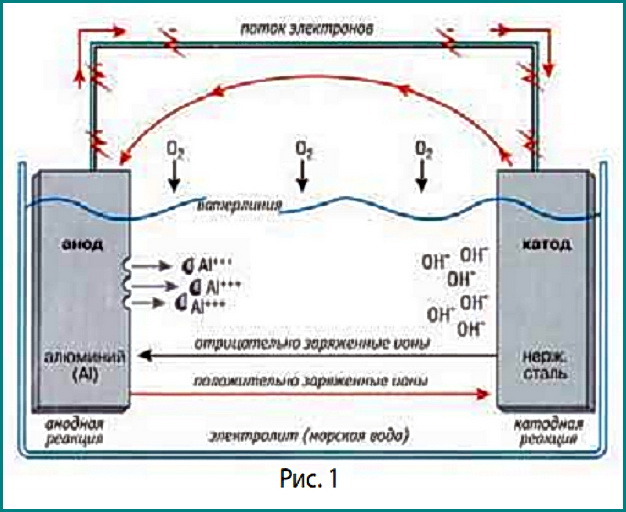
Процесс гальванической коррозии можно наиболее наглядно проиллюстрировать на примере алюминиевой подводной части подвесного мотора и гребного винта из нержавеющей стали. Алюминий — более химически активный металл — является в данном случае анодом, а менее активная нержавеющая сталь — катодом.
Вот что происходит, когда эта пара помещается в воду, играющую роль электролита (рис. 1):
1. На аноде:
а) через место контакта (в нашем случае — через гребной вал) электроны перетекают с анода, металла химически более активного, на катод — гребной винт. Происходит следующая реакция: Al – Al +++ + 3e;
б) при этом атомы химически более активного металла превращаются в ионы (этим термином обозначаются атомы с «недостатком» или «избытком» электронов), которые устремляются в воду и связываются с ионами кислорода, обмениваясь с ними электронами и образуя оксид алюминия. (Процесс этот ничем не отличается от того, что происходит с ионами железа при образовании оксида железа);
в) образовавшиеся молекулы оксида алюминия либо уносятся потоком воды, либо оседают на алюминиевой поверхности в виде белесого налета. Таким образом, подводная часть вашего подвесника в результате гальванической коррозии буквально растворяется в воде.
2. На катоде:
а) с анода поступают электроны, причем они не просто накапливаются, а вступают в реакцию с ионами электролита;
б) реакция обычно происходит такая: 1 1/2 О2 + 3 Н2О + 6 е – 6 ОН- ;
в) ион гидроокиси ОН- — щелочной, поэтому в районе катода образуется щелочная среда. (Это обстоятельство стоит иметь в виду владельцам деревянных корпусов — щелочь разрушает целлюлозу, хотя на практике повреждения обычно не столь значительны).
Очень важно понять, что следствием освобождения каждого положительного иона металла на аноде обязательно является формирование отрицательного иона электролита, образующегося вследствие реакции электронов катода.
Электрически анодные и катодные реакции должны быть эквивалентны. Рост или снижение уровня катодной реакции вызывает ответные рост или снижение уровня анодной реакции. Это ключевой факт для понимания процесса коррозии и управления им.
Его можно проиллюстрировать эффектом влияния размеров анода и катода. Если к очень большому аноду подключить маленький катод, процесс коррозии анода пойдет медленно. А если поступить наоборот, то анод очень быстро разрушится.
Алюминиевых деталей на катере или мотолодке полным-полно (не говоря уже о том, что алюминиевым может быть собственно корпус лодки!). И если не контролировать процесс гальванической коррозии, теоретически все они со временем способны «раствориться» без остатка.
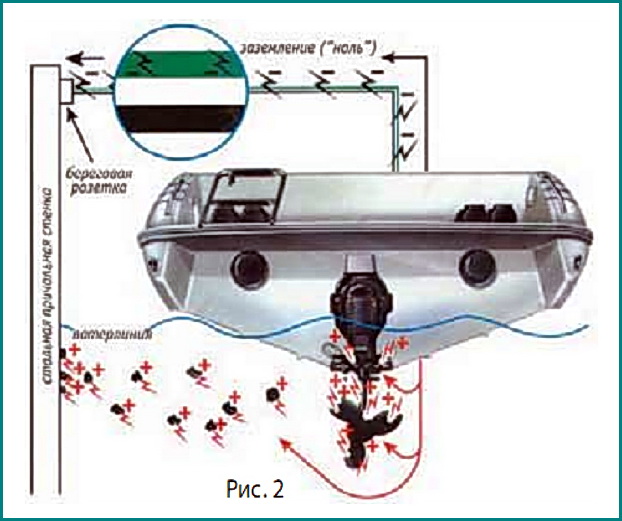
Гальваническая коррозия может протекать даже в том случае, если на вашей лодке нет ни одной детали из нержавеющей стали. Предположим, что и подводная часть мотора, и винт алюминиевые, но лодку вы обычно ставите у пирса со стальной стенкой и подключаетесь при этом к береговой системе электроснабжения.
Провод заземления (так называемый «третий» — дань безопасности) соединяет при этом алюминиевые детали лодки с погруженной в воду стальной стенкой (рис. 2). Если учесть внушительную массу стальной стенки, то и подводной части мотора, и винту грозят серьезные повреждения.
Предотвратить их можно при помощи гальванического изолятора — своеобразного фильтра, отсекающего токи низкого напряжения и позволяющего при этом заземляющему проводу в случае пробоя изоляции или короткого замыкания выполнить свою функцию — отвести ток в землю и спасти вам жизнь.
Основной метод борьбы с коррозией — это использование всевозможных защитных покрытий (в первую очередь краски), изолирующих анод,
но все же полностью решить проблему таким способом не удастся — хотя бы потому, что механические повреждения лакокрасочного покрытия подводных частей подвесных моторов или поворотно-угловых колонок являются самым обычным делом.
Первый признак гальванической коррозии — вздутие краски на поверхностях, расположенных ниже ватерлинии, начинающееся обычно на острых гранях, и образование на обнажившемся металле белесого порошкообразного налета. Потом на поверхности металла начинают образовываться заметные углубления (рис. 3).
Коррозию подводных частей подвесных моторов и угловых колонок — или любых алюминиевых частей лодки — значительно ускоряет наличие деталей из нержавеющей стали, таких, как гребные винты, транцевые плиты (особенно если они «заземлены» на двигатель), узлы дистанционного управления. Именно на них и уходят электроны алюминиевых деталей.
Но и без наличия нержавеющей стали расположенные под водой алюминиевые детали все равно подвергаются воздействию коррозии этого вида — хотя и не столь интенсивной, как при контакте с иным металлом.
При наличии электролита на большинстве однородных, вроде бы, металлических поверхностей все равно образуются крошечные аноды и катоды — в тех местах, где состав сплава неоднороден или имеются посторонние вкрапления или примеси — например, частицы металла с форм или штампов.
Нержавеющую сталь в качества катода и алюминий в качестве анода мы использовали лишь в качестве одного из примеров; образовать «батарею» для запуска гальванической коррозии в паре с алюминием способен любой другой металл.
Именно это и позволяет бороться с коррозией ответственных деталей — в паре с более активным металлом роль катода начинает играть уже алюминий, а небольшая контактирующая с ним деталь из цинка отдается ей «на съедение» и никаких больше функцией не несет.
Такие детали именуются анодными протекторами, и сейчас практически не встретишь подвесника или угловой колонки, которые были бы ими не снабжены. Итак, при контакте алюминия с цинком катодом становится алюминий, а подвергается коррозии цинк — металл более химически активный.
Поскольку анодный протектор корродирует достаточно активно, установленный на колонке кусочек цинка может «раствориться» буквально за одну навигацию, оставив алюминий без защиты. Поэтому состояние этих нехитрых деталей надо время от времени инспектировать и вовремя заменять их «свежими».
Один же из худших врагов алюминия при образовании гальванической пары — это медь или медные сплавы (латунь или бронза), поэтому использовать медный крепеж при установке алюминиевых узлов и деталей (например, водоотливных помп) категорически не рекомендуется.
Еще одна причина гальванической коррозии — подключение к береговой электросети, обычно снабженной заземляющим проводом. При этом алюминиевая подводная часть вашего мотора или колонки посредством его подключается к подводным частям других лодок и становится частью огромной гальванической батареи, связанной с погруженным в воду береговым металлом.
При этом не только на вашей лодке, но и на соседних коррозия значительно ускоряется. Мы рассмотрели, на что способна гальваническая коррозия при использовании электрического потенциала самих металлов. Представьте, что будет, если добавить еще электричества!
Произойти подобное может в том случае, если металл, по которому течет электрический ток, поместить в любой природный, т.е. изначально «заземленный» водоем. Ток через воду устремится в землю. Следствием этого явится интенсивная коррозия в том месте, где произошел «пробой».
Данная разновидность коррозии отличается от гальванической, хотя природа у них одна. Гальваническая коррозия вызывается соединением двух разнородных металлов и происходит за счет их электрических потенциалов. Один металл выступает в роли анода, другой — в роли катода.
Здесь же электрический ток попадает на подводную часть лодки из внешнего источника и через воду уходит в землю. К примеру, ваша лодка расположена между лодкой с утечкой постоянного тока и местом, являющимся хорошим заземлением для этого тока.
Хотя ток может уходить в землю и через воду, ваша лодка может явиться проводником со значительно меньшим сопротивлением. Таким образом, ток будет уходить в землю и с нее. Наиболее интенсивно коррозия будет развиваться в том месте лодки, откуда ток уходит в воду.
Блуждающие токи могут вызываться не только внешними, но и внутренними источниками — коротким замыканием в сети лодки, плохой изоляцией проводки, подмокшим контактом или неправильным подключением какого - либо элемента электрооборудования.
Наиболее же распространенный внешний источник этих токов — береговая сеть электроснабжения. Лодка с внутренним источником блуждающих токов (например, по причине повреждения изоляции одного из проводов) может стать причиной усиленной коррозии множества соседних лодок, подключенных к той же береговой электросети, если они обеспечивают лучшее заземление.
Ток при этом передается на другие лодки посредством все того же «третьего» заземляющего провода. Гораздо более неуловимый — но потенциально более опасный — случай коррозии блуждающих токов может происходить безо всяких проблем с электрооборудованием (и вашей лодки, и соседних).
Предположим, что вы возвращаетесь на стоянку после выходных на воде, подсоединяетесь к береговому источнику, чтобы подзарядить аккумулятор, и спокойно уходите домой — автоматическое зарядное устройство само отключит зарядившуюся батарею.
В понедельник по соседству с вашей лодкой причаливает большой стальной катер (с ободранной и поцарапанной краской). Владелец его тоже подключается к береговой сети и тоже оставляет свою посудину на несколько дней. Электрическая батарея готова — большой стальной корпус и небольшая подводная часть вашего мотора, соединенные заземляющим проводом.
В зависимости от разделяющего их расстояния, разницы размеров и времени, которое ваш сосед решил провести на берегу, в следующие выходные вы можете обнаружить, что подводная часть вашего мотора либо просто покрыта белесым налетом, либо разрушилась чуть ли не полностью.
В заключение — об известной всем «нержавейке» и так называемой щелевой коррозии, которой подвержены многие металлы, а в особенности — нержавеющая сталь.
«Щель» в данном случае — это пространство под всевозможными отложениями (песка, ила и т.д.), под пластиковыми шайбами, фетровыми прокладками и т.д. — иначе говоря, место, из которого попавшая туда влага не может найти выхода и где образовалась застойная зона.
Нержавеющая сталь — это сплав на основе чугуна, в который входят хром и никель. Не ржавеет она благодаря образующейся на поверхности изделия тонкой пленке оксида хрома. При отсутствии кислорода оксидный слой разрушается, и нержавеющая сталь покрывается ржавчиной не хуже обычной.
Иными словами, «нержавейка» не ржавеет только до тех пор, пока имеется доступ кислорода. В «щели», где влага кислорода практически лишена, эта разновидность стали теряет свои свойства.
Самый простой способ предотвратить данную разновидность коррозии — ограничить доступ влаги в «щели», вовремя удалять образующиеся отложения и обеспечить хорошую вентиляцию сомнительных мест.
Итак, вкратце перечислим меры, которые следует предпринимать для борьбы с коррозией на лодке:
— следить за состоянием лакокрасочного покрытия и вовремя восстанавливать поврежденные места;
— использовать рекомендованные заводом-изготовителем защитные покрытия и густые смазки;
— следить за состоянием анодных протекторов и в случае их значительного износа заменять их на новые;
— использовать в цепи подачи берегового питания фильтр слабых токов на заземляющем проводе;
— подключать лодку к береговой электросети только в случае необходимости (например, для подзарядки аккумуляторов).
Источник: «Катера и Яхты» , №223.



Комментариев нет:
Отправить комментарий